疫苗有效,先抛股票,今日官宣94.5%结果的Moderna高管早有信心
此前药物均未获得批准
萧箫 发自 凹非寺
量子位 报道 | 公众号 QbitAI
有效率94.5%,比此前公布的辉瑞新冠疫苗的有效率还要高出4.5%。

这是一家名为莫德纳 (Moderna)的美国公司所公布的三期临床中期报告。
与辉瑞相似,两家公司使用的都是最新的疫苗研发技术mRNA。
mRNA疫苗:将病毒刺突蛋白的mRNA直接注入人体,刺激产生抗体。由于不需要质粒(遗传物质,具有自主复制能力),因此安全性较高、免疫性强、制备较快。
目前的疫苗类型,主要包括全病毒疫苗、病毒载体疫苗、基于蛋白类疫苗和核酸疫苗四种,mRNA属于核酸疫苗。
与辉瑞一样,Moderna也计划在未来数周内申请紧急授权使用疫苗。
那么,相比于辉瑞疫苗,Moderna的疫苗目前最“能打”的是哪一部分?
最大优势:保存温度
相比于辉瑞,Moderna最大的优势应该就在于它的保存温度了。
根据CNN报道,辉瑞的疫苗必须在零下75℃左右保存,然而,不仅美国目前没有其他疫苗需要保持这种低温,普通医生的办公室和药房,也没有温度这么低的冷冻机。
然而Moderna的疫苗只需要保存在零下20℃的温度中,目前像水痘疫苗的保存,也是这个温度。
对此,Moderna的首席医疗官Tal Zacks表示:“Moderna的疫苗可以保存在大多数医院和药房都有的、随时可以使用的冷冻柜中。”

那么在普通冰箱的温度下(2-8℃左右),疫苗情况怎么样呢?
Moderna表示,这种疫苗的另一个优势是可以在普通冰箱中保存30天,但辉瑞的疫苗只能在冰箱中保存5天。
除此之外,也有网友从两份报告的试验对象中发现了细微的差别。
从Moderna公布的报告来看,目前试验对象包含11名重症患者,均在安慰剂组;相比之下,辉瑞公布的数据则没有重症患者。
不过,Moderna的疫苗同样存在副作用。
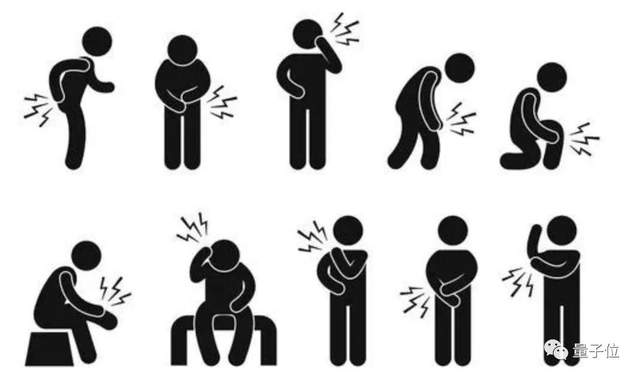
从目前已经公布的数据来看,第二次给药后,患者表现出了不同程度的症状:疲劳(9.7%),肌痛(8.9%),关节痛(5.2%) ,头痛(4.5%),疼痛(4.1%)和注射部位的红斑/发红(2.0%)。
不过,从Ⅲ期首次中期分析报告来看,Moderna的疫苗效果不输辉瑞,它究竟是一家什么样的公司?
与辉瑞一样,高管们也低买高卖过股票
Moderna是一家研发mRNA药物的美国生物技术公司,他们认为,基于mRNA制造的药物,具有改善患者健康的巨大潜力。
2010年,Moderna成立(名为ModeRNA Therapeutics),最初他们专注于传统高利润的慢性治疗领域,但试验大多不太成功。
2014年,Moderna转变策略,开始研究低利润疫苗,但在当时,这样的战略转变令行业专家和Moderna员工对公司的财务生存能力表示质疑。
2018年,公司更名为“Moderna Inc.”。12月,Moderna进行了有史以来最大的生物技术首次公开募股(IPO),以其8%的股份筹集了6亿美元,这意味着其总估值为75亿美元。

截至2020年11月,Moderna价值350亿美元。尽管他们的药物均未获得批准,但与辉瑞一样,Moderna也计划在未来数周内申请紧急授权使用疫苗。
这家公司在股票上,同样也存在着争议。
2020年5月18日,当Moderna宣布其冠状病毒疫苗取得进展时,公司股价上涨了30%。
宣布当天,首席财务官洛伦斯·金(Lorence Kim)以300万美元的价格购买了股票,并立即以1980万美元的价格将其出售。

第二天,首席医疗官塔尔·扎克斯(Tal Zaks)以150万美元的价格购买了股票,也立即以977万美元的价格将其出售。

而在11月16号,Moderna宣布他们的Ⅲ期首次中期分析报告后,Moderna的股票再次大幅上涨。

相比于Moderna,辉瑞和BioNTech的股票则都有不同程度的下跌。

除了公司以外,mRNA疫苗本身也存在着质疑。
依旧是mRNA的三个疑问
之所以mRNA疫苗被高度聚焦,是因为相比于全病毒疫苗、病毒载体疫苗、基于蛋白类疫苗这些已得到广泛应用的传统类型疫苗,核酸疫苗属于无同类疫苗获批过的新型疫苗。
这也就意味着,mRNA疫苗还没有同类疫苗获得过批准。
关于它的三个疑问,也一直存在:
①疫苗免疫力持续时间是多久?
②针对老年人是否有效?
③是否有助于缓解或阻止病毒传播?
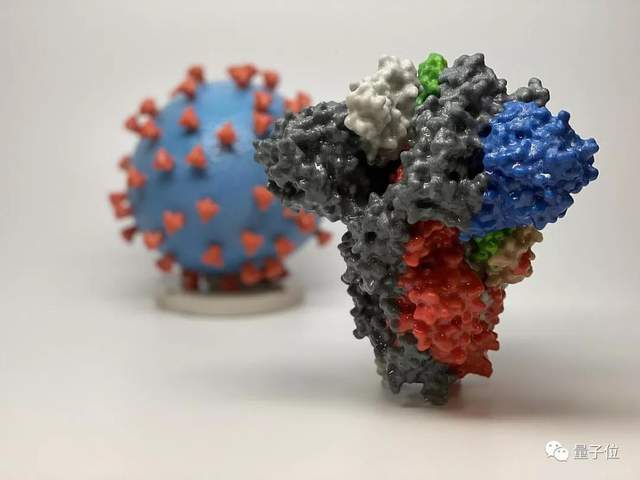
不过,虽然各类在研新冠病毒疫苗利用的研发平台不同,但都基于一个主要的理论基础:
新冠病毒,主要通过其表面刺突蛋白与人体细胞上的“血管紧张素转化酶2(ACE2)”受体结合实现感染。
新冠病毒疫苗,则以协助新冠病毒侵入细胞的刺突蛋白为靶点,通过表达刺突蛋白,诱导人体免疫系统产生能够结合新冠病毒的中和抗体,从而实现预防感染的目标。
目前几家主流公司进展情况
目前来说,目前各种类型的疫苗研发,都已经有领先的几家机构。
从全病毒疫苗来看,中国国药集团中国生物 (Sinopharm)开发的两支新冠疫苗,都已经进入了3期试验。
其中一支,今年6月已在阿联酋启动3期临床试验,参加入组试验的人数已超过2万。此外,他们研制的灭活疫苗已于7月22日在中国国内正式启动了紧急使用。
今年9月,中国生物公司开发的疫苗得到了阿联酋卫生部的授权,被列入紧急使用疫苗名单。这是中国第一支受到国际认可的疫苗。
从基于蛋白类疫苗来看,中国人民解放军军事科学院陈薇团队研发的重组新冠疫苗,早在今年3月就进入了1期临床试验,4月进入2期。

3期试验原本计划在加拿大进行,但未能成行,直到今年9月,该疫苗在俄罗斯和巴基斯坦获得3期临床试验的许可。
从病毒载体疫苗来看,英国的阿斯利康(AstraZeneca Life Science)新冠疫苗被各界普遍看好,今年9月却因严重副反应而暂停试验,数天后又恢复了临床试验。其临床试验已经在英国、巴西、南非等国铺开,总规模高达数万人。
至于核酸疫苗,则是近期先后公布Ⅲ期首次中期分析报告的辉瑞、BioNTech和Moderna。
那么,为什么中国的疫苗还没有相对进展?
对此,张文宏医生曾经表示:“中国疫苗在一期二期进行的速度都比较快,但就疫苗而言,由于国内的疫情控制得非常好,使得我们失去了在中国从事三期临床研究的一个机会。将来,我们中国几个跑在比较前面的疫苗如果要做临床研究,还要到国外疫情比较高发的地方去做。”

这就会面临着他国的语言、民族、法律等问题。
例如,国内疫苗在巴西的临床测试,曾因一名志愿者的死亡被迫暂停,然而随后调查发现死者是自杀,与疫苗无关。
随后,巴西卫生监管部门在上周宣布,将恢复对中国新冠疫苗的临床测试。
期待新冠疫苗早日研发成功。
Moderna的Ⅲ期首次中期分析报告:
https://investors.modernatx.com/news-releases/news-release-details/modernas-covid-19-vaccine-candidate-meets-its-primary-efficacy
辉瑞和BioNTech的Ⅲ期首次中期分析报告:
https://www.pfizer.com/news/press-release/press-release-detail/pfizer-and-biontech-announce-vaccine-candidate-against
参考链接:
https://www.nih.gov/news-events/news-releases/promising-interim-results-clinical-trial-nih-moderna-covid-19-vaccine
http://www.xinhuanet.com/politics/2020-04/08/c_1125828872.htm
https://en.wikipedia.org/wiki/Moderna#cite_note-reuters6-13
https://www.modernatx.com/about-us
https://www.dw.com/zh/%E5%85%A8%E7%90%8310%E4%B8%AA%E6%9C%80%E9%A2%86%E5%85%88%E7%9A%84%E6%96%B0%E5%86%A0%E7%96%AB%E8%8B%97%E9%A1%B9%E7%9B%AE/a-55187148
https://finance.sina.com.cn/world/gjcj/2020-11-12/doc-iiznezxs1367408.shtml
https://edition.cnn.com/world/live-news/coronavirus-pandemic-11-16-20-intl/h_3c91c6f3b13c0b6d96bd126d9cda9018
- 首个GPT-4驱动的人形机器人!无需编程+零样本学习,还可根据口头反馈调整行为2023-12-13
- IDC霍锦洁:AI PC将颠覆性变革PC产业2023-12-08
- AI视觉字谜爆火!梦露转180°秒变爱因斯坦,英伟达高级AI科学家:近期最酷的扩散模型2023-12-03
- 苹果大模型最大动作:开源M芯专用ML框架,能跑70亿大模型2023-12-07